根據電化學腐蝕原理,腐蝕過程中產生的電流大小可以代表腐蝕速率。由于陽極極化和陰極極化使腐蝕電池電位減小,從而降低腐蝕速率。產生陽極極化的主要原因是在腐蝕過程中,當溶液中有氧化劑時,在陽極表面產生了保護性的氧化膜,使金屬鈍化。其電位正移可達0.2~2V,可使腐蝕速率降低幾個數量級。
工(gong)業上廣(guang)泛應用(yong)的(de)鐵(tie)、鉻、鎳、鈦及其合(he)金的(de)活化(hua)(hua)(hua)(hua)-鈍(dun)(dun)化(hua)(hua)(hua)(hua)曲線(xian)具(ju)有特(te)殊的(de)形式,它們的(de)活化(hua)(hua)(hua)(hua)-鈍(dun)(dun)化(hua)(hua)(hua)(hua)轉(zhuan)變(bian)的(de)陽極(ji)(ji)(ji)極(ji)(ji)(ji)化(hua)(hua)(hua)(hua)曲線(xian)如圖9.1所示(shi)。圖中有三(san)個不(bu)同電(dian)(dian)化(hua)(hua)(hua)(hua)學行為區域:活化(hua)(hua)(hua)(hua)區A、鈍(dun)(dun)化(hua)(hua)(hua)(hua)區P和過鈍(dun)(dun)化(hua)(hua)(hua)(hua)區T。由于極(ji)(ji)(ji)化(hua)(hua)(hua)(hua)的(de)作用(yong),隨(sui)著(zhu)腐蝕(shi)電(dian)(dian)流強度(du)的(de)增加,陽極(ji)(ji)(ji)電(dian)(dian)位E。升(sheng)高(gao),當(dang)陽極(ji)(ji)(ji)極(ji)(ji)(ji)化(hua)(hua)(hua)(hua)曲線(xian)達到(dao)(dao)最(zui)大(da)值,相應電(dian)(dian)極(ji)(ji)(ji)電(dian)(dian)位為Ep,電(dian)(dian)流強度(du)為Ip時,產生了陽極(ji)(ji)(ji)鈍(dun)(dun)化(hua)(hua)(hua)(hua),陽極(ji)(ji)(ji)過程受到(dao)(dao)極(ji)(ji)(ji)大(da)障礙,此時電(dian)(dian)流強度(du)突然下降到(dao)(dao)最(zui)小值I最(zui)小,Ep稱為初始鈍(dun)(dun)化(hua)(hua)(hua)(hua)電(dian)(dian)位,Ip稱為臨(lin)界(jie)電(dian)(dian)流強度(du)。在很(hen)寬(kuan)的(de)陽極(ji)(ji)(ji)電(dian)(dian)位范(fan)圍(wei)內極(ji)(ji)(ji)化(hua)(hua)(hua)(hua)時,一直保持(chi)I最(zui)小的(de)腐蝕(shi)電(dian)(dian)流強度(du),此時腐蝕(shi)速(su)率大(da)大(da)降低,陽極(ji)(ji)(ji)處于鈍(dun)(dun)化(hua)(hua)(hua)(hua)區P。
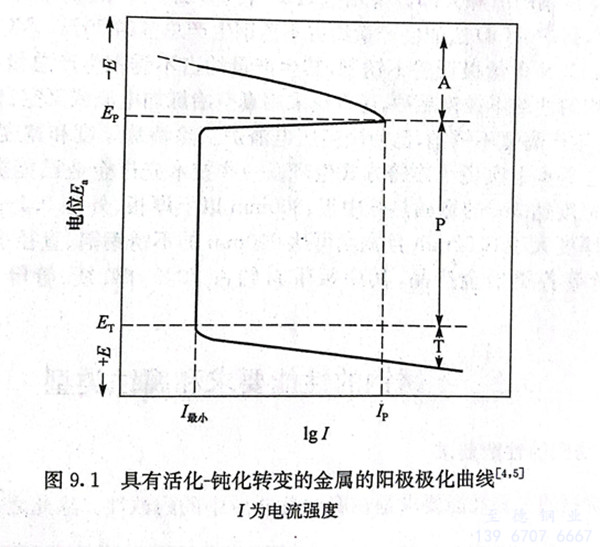
陽極(ji)電位超(chao)過(guo)Er后,腐蝕電流(liu)又增加,這種現象稱為過(guo)鈍化。ET稱為過(guo)鈍化電位,陽極(ji)處(chu)于過(guo)鈍化區(qu)T,此時(shi)金屬的腐蝕速率又增加。
根據(ju)具有(you)活化(hua)(hua)-鈍化(hua)(hua)轉變的(de)金屬或合金的(de)陽(yang)極極化(hua)(hua)曲線(xian)(xian)和(he)陰極極化(hua)(hua)曲線(xian)(xian)的(de)相對位(wei)置,可以分(fen)析該金屬和(he)合金鈍化(hua)(hua)狀態(tai)的(de)穩定性。



